
Kuva esittäjä (t): McCall Sarrett
Olipa unohtanut 20-vuotta elämääsi tai saman keskustelun viiden minuutin välein vain unohtamatta sitä joka kerta, muistin heikkeneminen voi vie paljon arkea. Se voi olla yksi hämmentävimmistä neurodegeneraation näkökohdista ja se on keskeinen dementian oire.
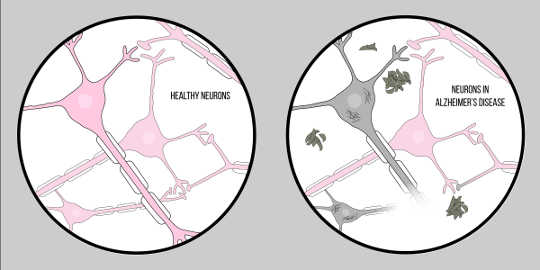
Alzheimerin tauti, tunnetaan myös AD, on yleisin dementian muoto, jolle on tunnusomaista kognitiiviset vaikeudet ja muistin menetys. Tällä hetkellä ei ole virallista kliinistä tekniikkaa AD: n diagnosoimiseksi, muut kuin ruumiinavaus. Alzheimerin taudin potilaiden aivokudoksen ominaispiirteitä on kuitenkin kaksi: amyloidi-beeta (A?) plakit ja neurofibrilliset tangles, jotka molemmat ovat antaneet huomattavan määrän tietoa neurodegeneraation patologiasta.
”Neurofibrillary tangles johtuu tau-proteiinien proteiinien puutteesta.”
A? on proteiini, joka syntyy proteolyysiä of Amyloidiprekursoriproteiini (APP). Tämä tarkoittaa, että APP leikataan pienemmiksi paloiksi, joista yksi on A? kappale. APP leikataan näihin paloiksi sekretaaseiksi kutsuttujen entsyymien toimesta, joiden ensisijainen tehtävä on pilkkoa näitä proteiineja. Erilaisia erittymiä on olemassa, mutta yksi, joka on merkittävä Alzheimerin taudin kannalta – gammasekretaasi. Gamma-sekretaasi tuottaa erityistä Aa:a: Ap-42:ta, proteiinin myrkyllisimpää muotoa. Kun nämä proteiinifragmentit hajoavat, ne alkavat kerääntyä solujen ulkopuolelle. Avain näiden proteiinien myrkyllisyyteen on, että ne ovat tyypillisesti "tahmeita", joten ne alkavat muodostaa aggregaatteja. Nämä aggregaatit kehittyvät edelleen, ja pian näitä amyloidibeetaplakkeja on kaikkialla, mikä heikentää suuresti hermosolujen toimintaa.
 Kuvaa McCall Sarrett
Kuvaa McCall Sarrett
Tämä vaikutus A? on johtanut neurologiseen toimintaan Amyloidihypoteesi, hyvin tunnettu teoria, joka ehdottaa selitystä neurodegeneraatiolle Alzheimerin taudissa.
Nyt, toinen keskeinen ominaisuus: neurofibrillary tangles. Neurofibrillary tangles syntyy proteiinien, joita kutsutaan tau-proteiineiksi, puutteesta. Tau-proteiinit toimivat sillana solujen sisällä mikrotubuleiksi kutsuttujen rakenteiden välillä. Mikrotubulit ovat tukimolekyylejä, jotka tarjoavat muodon ja rakenteen soluille, erityisesti aksoneille. Tau-proteiinit auttavat näitä mikrotubuleja muodostamaan rakenteen aksoneille. Jos kyseessä on kuitenkin Alzheimerin tautiNeurodegeneratiivinen sairaus, jolle on tunnusomaista neuronaalinen häviö, tau-proteiinit, jotka erittyvät ja kertyvät solurunkoon, muuten tunnetaan nimellä soma. Tämä aiheuttaa aksonien rappeutumisen, minkä vuoksi neuronien on vaikeampi kommunikoida. Tämä neuronaalisessa viestinnässä esiintyvä vaikeus on samanlainen kuin amyloidibetan vaikutukset; On kuitenkin tärkeää huomata, että nämä tangles eroavat suuresti aikaisemmin käsitellyistä plakkeista, koska ne vaikuttavat viestintään solun sisältä vastakohtana ulkopuolelle.
”Tutkijat eivät ole vieläkään varmoja siitä, millainen mekanismi vastaa Alzheimerin taudista.”
Vaikka molemmat ovat erittäin vaikutusvaltaisia, A? ja tau eivät ole ainoita merkityksellisiä tekijöitä Alzheimerin taudin patologiassa. Tutkimukset ovat ehdottaneet, että apolipoproteiini E (APOE) geeni voi olla yhtä vaikutusvaltainen kuin A?. On olemassa kolme päävarianttia, jotka koodaavat proteiineja: ApoE2, ApoE3 ja ApoE4. ApoE4:n on osoitettu korreloivan synaptisen karsimisen vähenemisen kanssa, kun taas ApoE2 johtaa lisääntymiseen. Molemmat muodot vaikuttavat astrosyytit (tärkeä glia-solut hermoston sisällä) ja ovat korreloitu niiden fagosytoosin nopeuteen, joka on prosessi, jolla astrosyytitTähti-muotoiset glia-solut, joilla on useita toimintoja, mukaan lukien solukkomateriaali. Kukin ApoE-variantti vaikuttaa suoraan tähän fagosytoosinopeuteen, ApoE2iin, mikä johtaa lisääntymiseen ja ApoE4-arvoon. Tämä viittaa siihen, että astrosyytit voivat olla vähemmän kykeneviä poistamaan solussa liikkuvat roskat, kun ne korreloivat ApoE4: n kanssa. Siten kun nämä plakit muodostuvat, ApoE4-genotyyppi voi estää näiden aggregaattien puhdistumisen, mikä edistää degeneroitumista.
Amyloidi-beeta, tau ja erilaiset geenit toimivat yhdessä, jotta ne aiheuttavat merkittävän viestintäongelman solujen välillä, mikä on lähinnä Alzheimerin tautia. Tällainen neurodegeneraatio on yleisimpiä aivojen alueilla, jotka liittyvät oppimiseen ja muistiin, mutta lopulta leviävät koko aivoissa. Tämän tiedon puutteen vuoksi synapsien menetys ja lopulta aivojen merkitys vähenee. Siten on normaalia nähdä aivokudoksen väheneminen a MKMagneettiresonanssikuvaus, tekniikka, jolla katsotaan taudin etenemistä, kun sairaus etenee, paljastaa, että Alzheimerin taudin tauti kutistuu aivoissa. Nykyiset oppimis- ja muistimallimme osoittavat, että synapseilla on keskeinen rooli näissä prosesseissa, mikä antaa mahdollisuuden selittää, miten tämä patologia korreloi AD: n suurimpien oireiden kanssa, kuten muistin menetys.
Tiedemiehet ovat edelleen epävarma Alzheimerin taudin patologiasta vastaavasta mekanismista. Monia innovatiivisia menetelmiä on tutkittu pyrittäessä saamaan lisää tietoa tästä patologisesta pisteestä, joista toinen on selkäydinnesteiden (CSF) biomarkkereita.
Tasot A? ja tau voidaan mitata aivo-selkäydinnesteestä toimenpiteellä, jota kutsutaan lannepunktioksi, joka kerää aivo-selkäydinnestettä. Lisääntynyt tau-taso ja vähentynyt A? havaitaan Alzheimerin tautia sairastavilla potilailla. Tämä on seurausta A? kertyminen aivoihin, mikä puolestaan johtaa alentuneeseen pitoisuuteen CSF:ssä. Nämä tiedot viittaavat siihen, että tulevaisuudessa lääkärit ja tutkijat voivat pystyä ennustamaan potilaan kognitiivisen tilan tutkimalla aivo-selkäydinnesteen proteiinitasoja.
Tällä hetkellä ei ole olemassa lopullista parannusta Alzheimerin taudille. Silti lisääntyvä tieto kyseisistä patologisista proteiineista, niihin liittyvistä geeneistä ja jatkuvasta tieteellisestä tutkimuksesta antaa toivoa tehokkaasta hoidosta tulevaisuudessa.
Mikä läpimurto on mielestänne tarpeen lääketieteessä Alzheimerin taudin hoitoon? Kerro meille kommenteista!
Tämä artikkeli on alun perin ilmestynyt Neuronien tunteminen?
Author
Khayla Black on New Yorkin yliopiston Shanghain fani, joka aikoo julistaa merkittävän neurologisissa tieteissä tietojenkäsittelytieteessä, jossa on keskittyminen keinotekoiseen älyyn. Tulevaisuudessa hän toivoo saavansa MD / PhD: n ja hänestä tulee neurotieteilijä, joka tutkii oppimisen ja muistin molekyylisiä näkökohtia. Vapaa-aikanaan Khayla nauttii työstä MYELIN-aloitteen kanssa IYNA: ssa sekä lukemassa kaikkia neurotieteellisiä materiaaleja. Neurotieteen opiskelun ulkopuolella hän nauttii juoksemisesta, opettamisesta paikallisissa peruskouluissa, matematiikkaongelmien ratkaisemisessa ja juomassa valtavia määriä kahvia.
Liittyvät kirjat
at InnerSelf Market ja Amazon
Viitteet
Lacor, PN, Buniel, MC, Furlow, PW, Clemente, AS, Velasco, PT, Wood, M., . . . Klein, WL (2007, 24. tammikuuta). A? Oligomeerin aiheuttamat poikkeamat Synapse Koostumus, muoto ja tiheys tarjoavat molekyylitason Alzheimerin taudin yhteyden katoamiselle. Haettu osoitteesta http://www.jneurosci.org/content/27/4/796
Murphy, MP ja LeVine, H. (2010). Alzheimerin tauti ja a-amyloidipeptidi. Alzheimerin taudin lehti?: JAD, 19(1), 311. http://doi.org/10.3233/JAD-2010-1221
O'Brien, RJ, & Wong, PC (2011). Amyloidiprekursoriproteiinien käsittely ja Alzheimerin tauti. Neurotieteen vuosikatsaus, 34, 185-204. http://doi.org/10.1146/annurev-neuro-061010-113613
Chung, W.-S., Verghese, PB, Chakraborty, C., Joung, J., Hyman, BT, Ulrich, JD,… Barres, BA (2016). APOE: n uudet alleeliriippuvaiset roolit synapseNeuronien väliset yhteydet, joissa signaali siirretään, ... astrosyyttien leikkaaminen. Kansallis-Akatemian tiedeakatemian artikkelit, 113(36), 10186-10191. http://doi.org/10.1073/pnas.1609896113
Zetterberg, H. (2009, 19. elokuuta). Amyloidi? ja APP Alzheimerin taudin biomarkkereina. Haettu osoitteesta https://www.sciencedirect.com/science/article/pii/S0531556509001594?via=ihub























